El ‘reparoma humano’, publicado en Science, identifica cómo cada uno de los 20 000 genes afecta a la reparación del ADN. Este recurso permitirá avanzar en el diseño de terapias contra el cáncer y mejorar las herramientas de edición genética, según los autores.
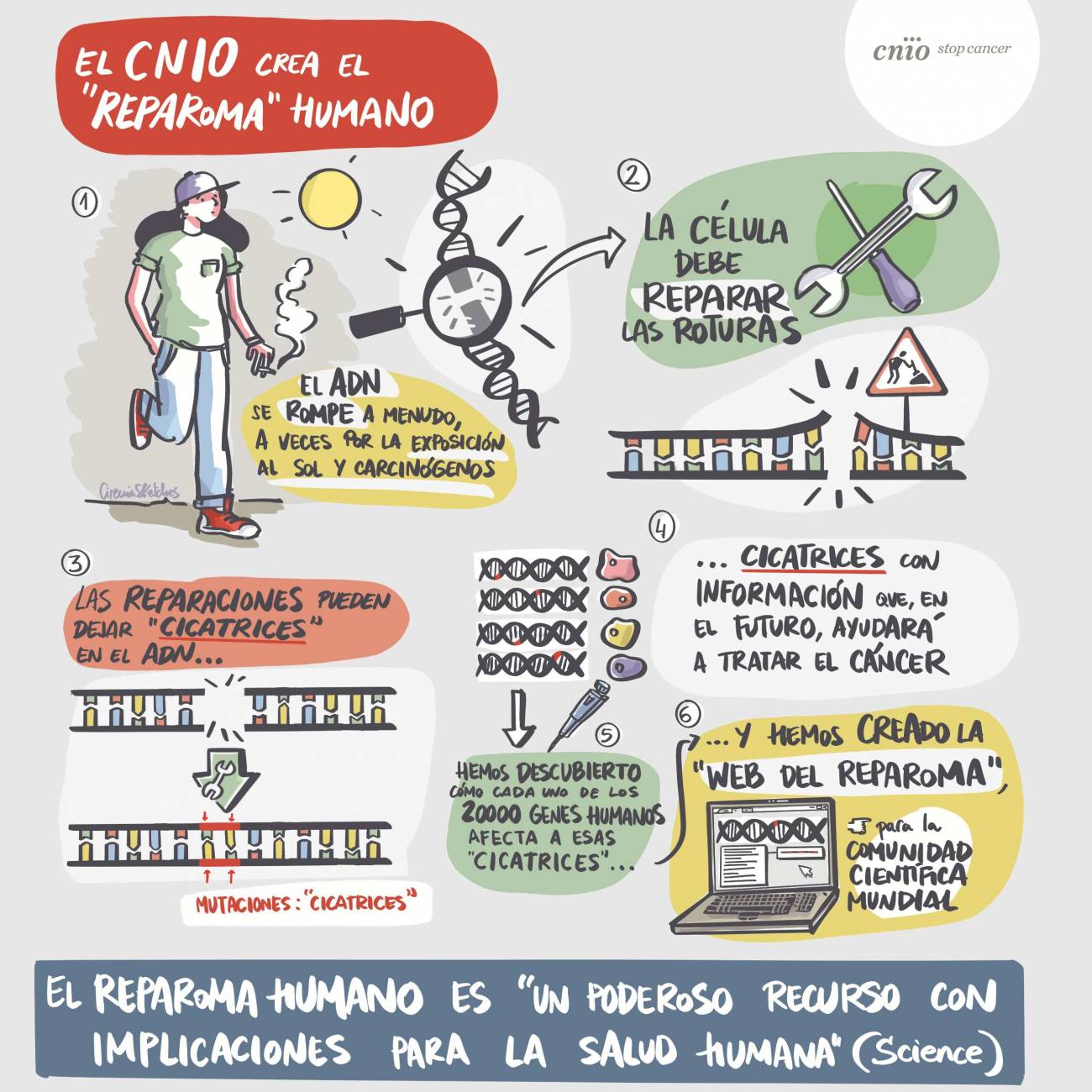
Un equipo del Centro Nacional de Investigaciones Oncológicas (CNIO) ha presentado hoy en Science el ‘reparoma humano’, (REPAIRome), el primer catálogo que recopila cómo se reparan las roturas del ADN en nuestras células.
El trabajo ha identificado identifica 20 000 patrones de cicatrices genéticas —tantos como genes— y los pone a disposición de la comunidad científica en un portal abierto, con aplicaciones que van desde la investigación básica hasta el diseño de tratamientos contra el cáncer.
El proyecto ha identificado y clasificado 20 000 patrones distintos, tantos como genes, y los ha organizado en un portal de libre acceso para la comunidad científica. Este conocimiento básico tiene un alto valor clínico: interpretar las cicatrices en el ADN tumoral de un paciente puede ayudar a seleccionar el tratamiento más adecuado.
“Es un trabajo ambicioso, que esperamos se convierta en un recurso verdaderamente útil en la investigación oncológica y también en la práctica clínica”, señala Felipe Cortés, jefe del grupo de grupo de Topología y Roturas de ADNdel CNIO y autor principal del estudio.
El ADN sufre roturas continuas, por procesos celulares y factores externos como la radiación solar. Para sobrevivir, la célula debe repararlas, aunque esas arreglos dejan una huella: mutaciones o ‘cicatrices’.
Esas huellas, señalan los autores, encierran información muy valiosa. Igual que las marcas en la piel son distintas tras un corte o una quemadura, las alteraciones en el ADN después de una reparación delatan el tipo de daño sufrido. También revelan detalles sobre el mecanismo de reparación utilizado por la célula.
Decodificar estas cicatrices es crucial en oncología, ya que muchas terapias actúan provocando roturas en el ADN. Con frecuencia, los tumores se hacen resistentes porque aprenden a repararlas. Conocer cómo lo hacen puede ayudar a superar estas resistencias.
Infografía reparona humano. / @CireniaSketches (CNIO)
El avance radica en haber determinado cómo influye cada gen en las cicatrices del ADN. Para construir el reparoma, los investigadores crearon 20 000 poblaciones celulares, inhabilitando un gen distinto en cada una. Después, provocaron roturas mediante CRISPR y analizaron la huella resultante.
Un desarrollo tecnológico clave ha permitido realizar este análisis simultáneo en las 20 000 poblaciones. “Esta aproximación puede emplearse en futuros estudios que analicen de manera global el efecto de todos los genes humanos”, explica Israel Salguero, coprimer autor.
El proyecto ha requerido “un importante esfuerzo computacional, que ha incluido el desarrollo de nuevas herramientas de análisis y representación”, señala Daniel Giménez, investigador del grupo de Dinámica Cromosómica del CNIO, también coprimer autor.
Por esta razón participan en esta investigación también los grupos de Oncología Computacional y de Integridad Genómica y Biología Estructural del CNIO.
E “Es un recurso poderoso para la comunidad científica, con aplicaciones en la biología y el tratamiento del cáncer, y también en la mejora de la edición genética CRISPR Cas”, escriben los autores en Science.
El catálogo se centra en las roturas de doble hebra, el daño más grave que puede sufrir el ADN. Estas lesiones son también la base de terapias como la radioterapia y la quimioterapia. Por ello, comprender cómo se reparan es esencial para identificar nuevas dianas terapéuticas y perfeccionar las herramientas de edición genética.
El proyecto ha recibido financiación estatal y europea a través del programa conjunto A way of making Europe del Ministerio de Ciencia, Innovación y Universidades (Agencia Española de Investigación, AEI) y los fondos FEDER, además de la Fundación “la Caixa”, la Asociación Española Contra el Cáncer (AECC) y la Comunidad de Madrid.
Referencia:
Ernesto López de Alba, Israel Salguero, Daniel Giménez et al “A comprehensive genetic catalog of human double-strand break repair”. Science, 2025