Bioingenieros de EE UU han creado una plataforma que genera redes vasculares artificiales en minutos y mejora la viabilidad de tejidos vivos impresos en 3D. El avance resuelve uno de los principales retos para fabricar órganos trasplantables a partir de las propias células del paciente: una vascularización eficaz y a gran escala.
España mantiene desde hace más de tres décadas su liderazgo mundial en trasplantes. En 2024 batió su propio récord con 6 464 intervenciones, una tasa de 132,8 por millón de habitantes, según la Organización Nacional de Trasplantes (ONT).
Sin embargo, las listas de espera persisten, y existe riesgo de rechazo incluso cuando hay buena compatibilidad. Para evitarlo, la medicina regenerativa busca fabricar corazones, riñones, hígados y otros órganos a medida a partir de células del propio paciente.
Uno de los mayores retos es garantizar que el oxígeno y los nutrientes lleguen a todas las partes del nuevo órgano. Ahora, investigadores de la Universidad de Stanford (EE UU) han desarrollado herramientas que permiten diseñar e imprimir en 3D los complejos árboles vasculares necesarios para transportar sangre. Sus resultados se publican en Science.El equipo ha creado una plataforma algorítmica capaz de generar redes vasculares en cuestión de minutos —hasta 230 veces más rápido que los métodos actuales—, con capacidad para simular patrones de flujo y presión. Usaron esta tecnología para diseñar redes en más de 200 modelos anatómicos y de ingeniería.
El sistema genera estructuras vasculares adaptadas a la forma de distintos tejidos con una velocidad sin precedentes y un diseño que recuerda al del cuerpo humano, explican los autores.
“La posibilidad de escalar los tejidos bioimpresos está limitada por la capacidad de crear vasos sanguíneos: no se puede aumentar su tamaño sin garantizar un suministro adecuado”, señala Alison Marsden, catedrática de Pediatría y experta en bioingeniería cardiovascular en Stanford.
“Hemos logrado que el algoritmo funcione unas 200 veces más rápido que los métodos anteriores y que se adapte a formas complejas, como órganos”, añade la autora principal del estudio.
En el cuerpo humano, la sangre fluye desde arterias grandes hasta vasos cada vez más pequeños, donde se produce el intercambio de gases y nutrientes con los tejidos. Para sobrevivir, las células deben estar muy cerca de estos capilares: en el corazón, puede haber más de 2 500 por milímetro cúbico.
Estas redes vasculares varían entre órganos e incluso entre individuos, lo que dificultaba hasta ahora su modelado. Muchos laboratorios recurrían a redes estandarizadas que funcionan en tejidos pequeños, pero no escalan bien.
El nuevo algoritmo permite crear árboles vasculares que imitan fielmente la arquitectura de los vasos en órganos reales. El software está disponible en código abierto a través del proyecto SimVascular.
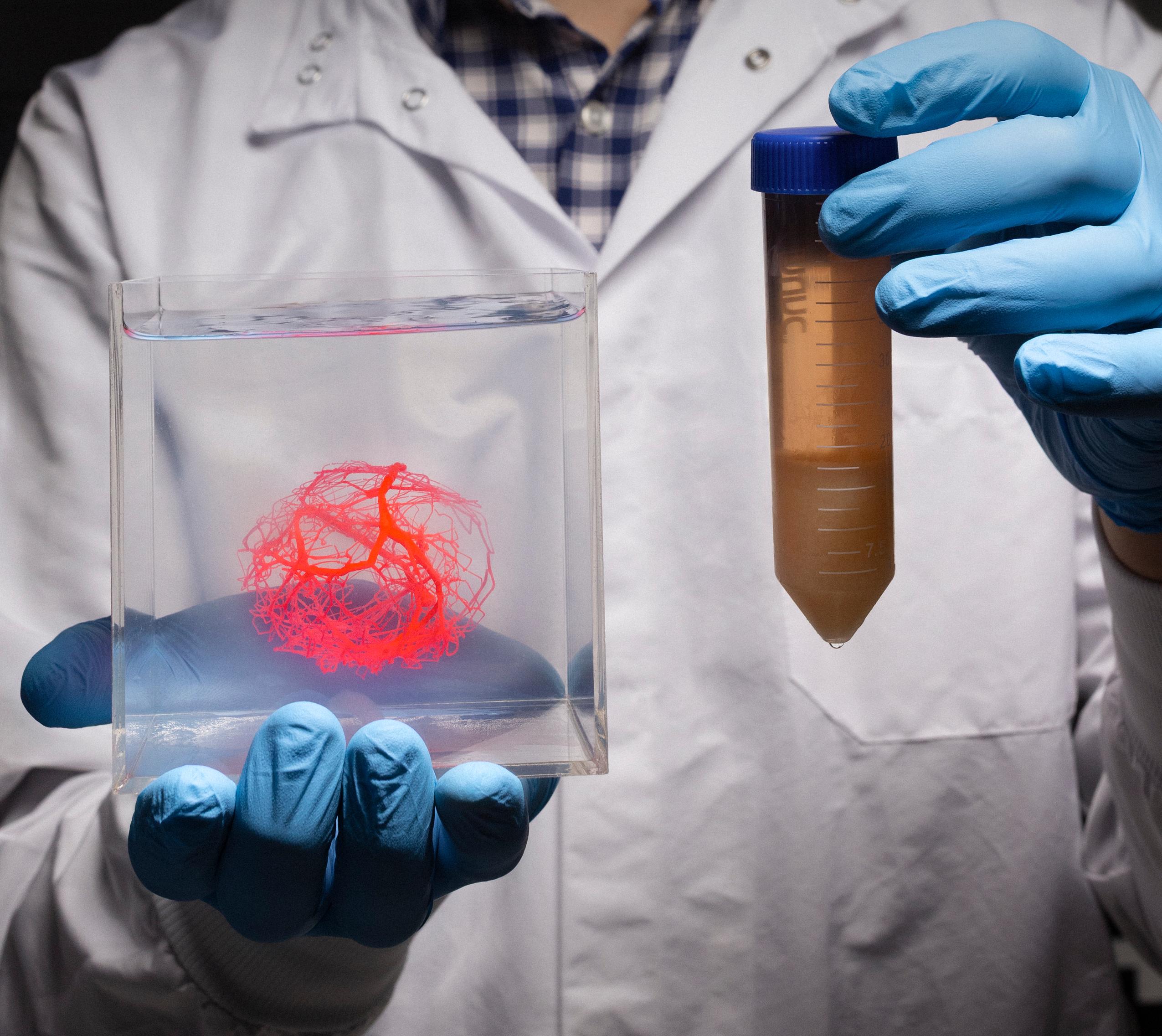
Árbol vascular impreso junto a miles de millones de cardiomiocitos (células cardíacas contráctiles) derivados de células madre humanas. / Andrew Brodhead
Para garantizar un flujo homogéneo, el equipo incorporó simulaciones de dinámica de fluidos, optimizando el tiempo de diseño y evitando colisiones entre vasos. Además, lograron generar redes con una única entrada y salida.
“Tardamos unas cinco horas en generar un modelo para vascularizar un corazón humano”, explica Zachary Sexton, primer autor del estudio. “Cada célula estaba a menos de 150 micras del vaso más cercano, lo que es excelente. Este diseño contenía un millón de vasos sanguíneos, algo que antes habría llevado meses lograr”.
Aunque las impresoras 3D aún no alcanzan la resolución necesaria para redes muy densas, el equipo imprimió un modelo con 500 ramificaciones y probó una versión simplificada con células renales humanas y una red de 25 vasos. Al bombear un líquido rico en oxígeno y nutrientes, lograron mantener vivas muchas células cercanas.
Más allá de imprimir vasos, el equipo también trabaja en inducir el crecimiento natural de los capilares más finos —que no pueden imprimirse— y en mejorar la precisión y velocidad de las bioimpresoras.
El estudio contó con la colaboración del Maternal & Child Health Research Institute, especializado en anatomía cardíaca infantil. Según explica Marsden a SINC, la participación de este centro se relaciona con las cardiopatías congénitas: “Los niños con estos defectos suelen pasar por múltiples cirugías reconstructivas y, a veces, requieren un trasplante”.

Hay una gran escasez de órganos para estos casos. Disponer de tejido cardíaco vivo, o incluso órganos completos, cambiaría radicalmente las posibilidades para la cirugía cardíaca pediátrica

“Existe una gran escasez de órganos para estos casos. Disponer de tejido cardíaco vivo, o incluso órganos completos, cambiaría radicalmente las posibilidades para la cirugía cardíaca pediátrica”, afirma la experta.
Por su parte, Zachary Thierman, primer firmante del trabajo, explica a SINC que la colaboración con este centro cardiaco infantil aprovecha sus imágenes de alta fidelidad y el profundo conocimiento clínico de los pacientes con cardiopatías congénitas, “lo que supone un gran incentivo para el desarrollo de tejidos cardíacos artificiales”.
Thierman subraya que el laboratorio de Marsden, en el que él trabaja, colabora estrechamente con cirujanos pediátricos para mejorar el tratamiento de casos complejos. “Las cardiopatías congénitas afectan al 1 % de los recién nacidos y son la principal causa de mortalidad en los primeros meses de vida”. Indica que el tratamiento actual de estas dolencias es paliativo, no curativo.
“Consideramos que este trabajo es el comienzo de lo que podría ser una cura bioingenieril y regenerativa en este ámbito: modelar la física y el rendimiento de posibles tejidos u órganos artificiales para crear diseños adecuados para la biofabricación y, algún día, sustituir los tejidos dañados o defectuosos”.

El trabajo abre la puerta a una posible cura bioingenieril y regenerativa para las cardiopatías congénitas, mediante el diseño de tejidos artificiales aptos para la biofabricación

Aún quedan importantes obstáculos técnicos para fabricar órganos funcionales. “Debemos imprimir más rápido y ensamblar tejidos con múltiples tipos celulares, como las células endoteliales que recubren los vasos”, dice Marsden a SINC. “Aunque demostramos viabilidad celular cerca de los vasos, necesitamos perfusión sanguínea en todo el tejido, lo que exige redes macro y microvasculares”.
Thierman añade que será necesario integrar conocimientos de distintas áreas de la biología. “Uno de los mayores desafíos es lograr que los distintos tipos celulares trabajen juntos como un solo tejido. Hemos conseguido escalar la obtención de células, pero aún enfrentamos limitaciones en hardware, software y biología”.
Desde el punto de vista computacional, fabricar órganos a escala humana exige primero diseñarlos y validar hipótesis digitalmente, antes de imprimir.
Según el comentario de expertos que acompaña el estudio en Science, esta tecnología podría transformar la biofabricación, ya que permite evaluar el rendimiento de las redes antes de imprimir, evitando el enfoque tradicional de prueba y error.
No obstante, recuerdan que los vasos no solo transportan sangre: también responden a estímulos, remodelan su estructura y se adaptan al entorno. Por eso, integrar modelos más complejos —como la angiogénesis o el comportamiento dinámico de las células endoteliales— será clave.
A largo plazo, la combinación de simulación, impresión y aprendizaje automático permitirá desarrollar diseños vasculares capaces de evolucionar junto con los tejidos. Además, esta plataforma podría servir para simular enfermedades vasculares y probar tratamientos personalizados en modelos digitales antes de aplicarlos en pacientes.